https://www.frontiersin.org/articles/10.3389/fmicb.2021.792698/full
https://www.sciencedirect.com/science/article/abs/pii/S0048969718310635
https://www.sciencedirect.com/science/article/abs/pii/0956053X95000382
https://www.sciencedirect.com/science/article/abs/pii/S0169772218300147
https://www.sciencedirect.com/science/article/abs/pii/S1001074213605355
Biodisponibilité des xénobiotiques
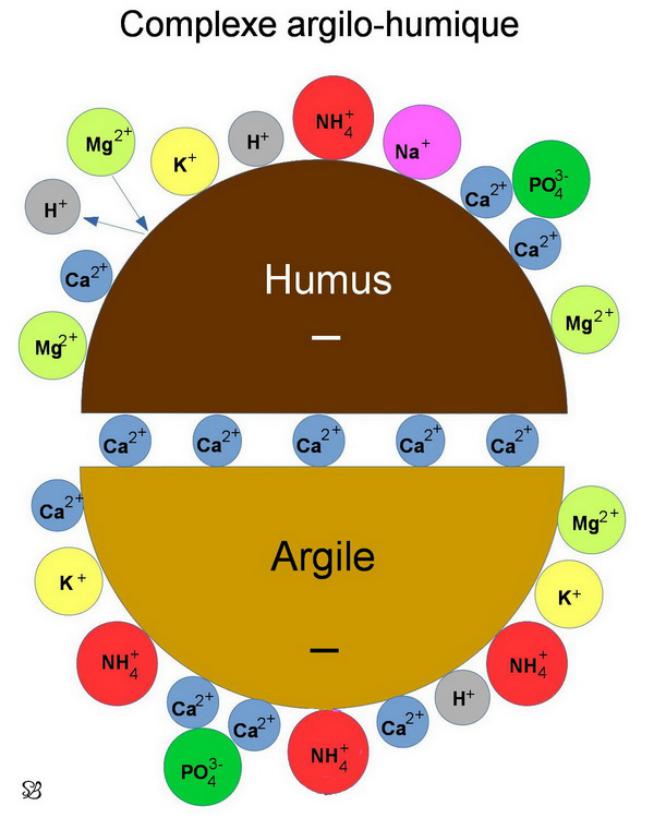
La quantité d’absorption de minéraux est différente selon leurs degrés de complexation avec le complexe argilo humique que sous forme libre. Dans la nature les ions s’agrègent sous forme colloïdale à l’acide humique avec l’aide de mycorhizes qui dégradent la matière organique, elle-même dégradé par les bactéries. Les vers de terre transportent l’argile du sous sol vers la surface, ils possèdent une glande qui fixe l’acide humique et l’argile par l’intermédiaire du calcium pour formé le complexe argilo humique. Ce qui rend les ions libres plus chélatables par les plantes. Pour transformer ses pollutions la remédiation est une solution, c’est une technique de dépollution basée sur les plantes et leurs interactions avec le sol et les microorganismes. Elle est présente sous différentes formes : La rhizofiltration, La phytostabilisation, La phytoextraction, La phytodégradation, La phytovolatilisation et la phytostimulation.
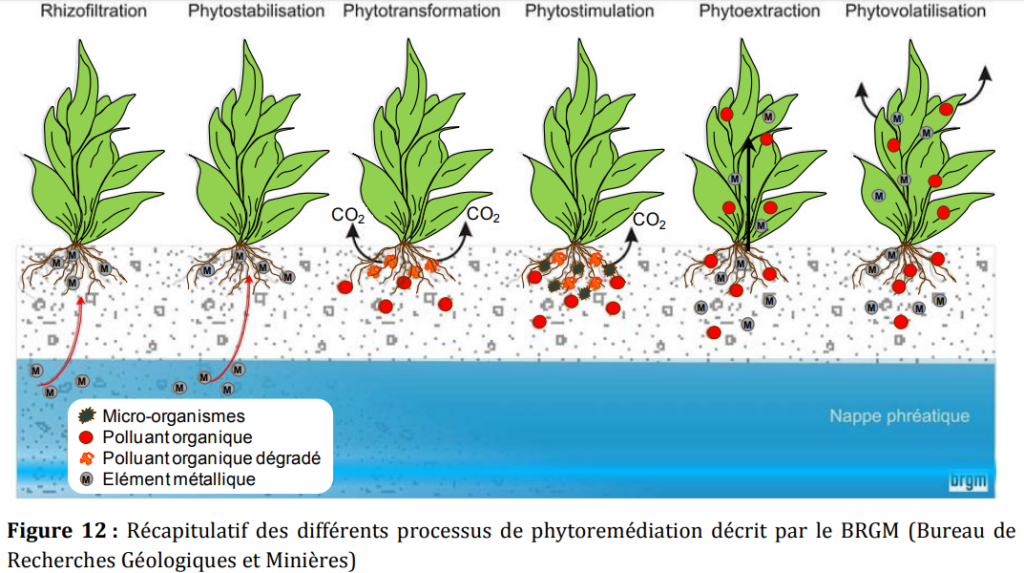
La phytoremédiation exploite les processus physiologiques naturels des plantes dans le but de dépolluer les sols et de restaurer les écosystèmes. Cette technique est avantageuse d’un point de vue économique et écologique mais présente une efficacité sur du long-terme. La phytoremédiation des contaminations organiques est optimale lorsque les contaminants sont biodisponibles et possèdent les caractéristiques physico-chimiques suivantes : masse moléculaire suffisamment faible (PM<logKow<pH). Par ailleurs, le succès de la phytoremédiation repose sur des plantes candidates présentant certaines qualités requises pour une efficacité optimale. Il s’agit d’une hypertolérance aux concentrations du polluant à traiter, d’une adaptation optimale au climat, d’un développement racinaire et foliaire important, d’un fort pouvoir d’immobilisation, d’extraction, de transport des polluants ainsi qu’une capacité à détoxiquer les polluants. Les polluants peuvent être extraits des matrices contaminées, stockés, transférés, détoxiqués par différents mécanismes qui peuvent intervenir soit espacés dans le temps.
La phytostabilisation : C’est l’immobilisation des contaminants par implantation d’un couvert végétal avec des plantes tolérantes à la pollution mais non accumulatrices. Le 50 but est de réduire l’érosion éolienne, le ruissellement des eaux et la lixiviation du sol vers les nappes phréatiques. Il ne s’agit pas réellement d’une technologie pour nettoyer les sols contaminés mais plutôt d’une stratégie de management des contaminants potentiellement toxiques par stabilisation (inactivation).
La rhizodégradation : Il s’agit de la décomposition des contaminants du sol grâce à l’activité microbienne dans la zone des racines des plantes. La rhizosphère est une zone de croissance microbienne et d’échanges (sol-microorganismes-plante). Les activités microbiennes de cette zone rhizosphérique peuvent agir sur l’absorption et la biodégradation des polluants facilitant l’absorption ultérieure des polluants primaires et secondaires par la plante.
La phytoextraction : C’est l’absorption des contaminants par les racines, dont une fraction est transférée vers les parties aériennes. La plante idéale pour la phytoextraction doit tolérer le toxique aux concentrations présentes dans l’environnement, croître rapidement, être capable d’accumuler le toxique et facilement récoltable
La phytodégradation ou phytotransformation : Un contaminant peut être dégradé chimiquement par les systèmes enzymatiques des plantes (phase I et II) catalysant des réactions d’oxydation, d’hydrolyse et/ou de conjugaison. Les capacités de détoxication des polluants chez les plantes génèrent des métabolites qui sont non ou moins toxiques que les composés initiaux.
La phytovolatilisation : Lorsque les plantes sont utilisées pour remédier des polluants à caractère volatile, il est possible d’obtenir (après phytoextraction et transport vers les feuilles) une perte des polluants et/ou de leurs métabolites au niveau foliaire. Ce processus est négatif en therme de phytoremédiation puisque la pollution se trouve déplacée d’un compartiment à un autre sans pour autant diminuer la charge polluante. Pour améliorer l’efficacité et la rapidité du processus de phytoremédiation, certains auteurs préconisent l’utilisation d’organismes génétiquement modifiés (OGM) même si la législation française n’autorise pas à ce jour leurs utilisations. En effet, certaines plantes modifiées peuvent surexprimer des gènes de dégradation des polluants. Par 51 exemples, le Liriodendron tulipifera pouvant exprimer le gène du mercure reductase des bactéries retient 10 fois plus de mercure que L. tulipifera sauvage. Augmenter l’expression des gènes des cytochromes comme CYP1A1 permettant la remédiation de l’atrazine est aussi un axe de recherche envisageable (Kawahigashi et al, 2006).
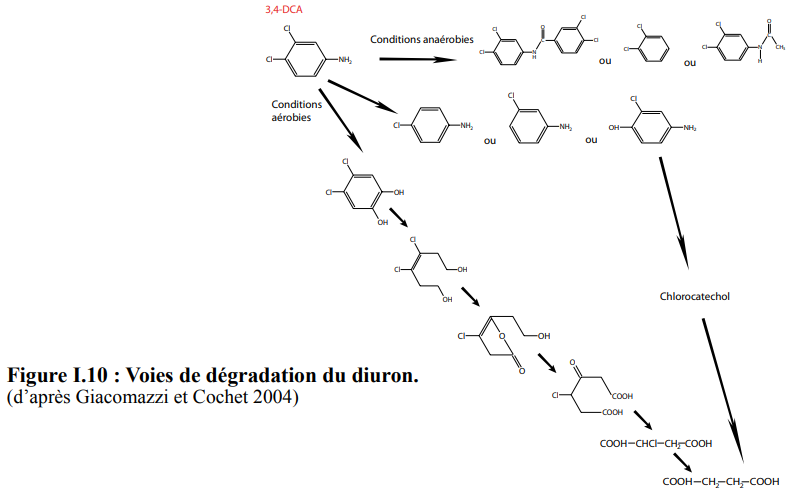
La bioatténuation est une méthode relativement simple, puisqu’elle consiste à laisser le système évoluer seul et à constater la diminution de la teneur en polluants, par les phénomènes de biodégradation, volatilisation, dispersion, dilution, décroissance radioactive. Elle est parfois appelée bioremédiation intrinsèque. Elle a été observée pour des pesticides, notamment le diuron. La bioatténuation ne garantit pas que les polluants soient durablement dégradés, mais au moins qu’ils ne soient plus bioaccessibles. La bioatténuation peut fonctionner dans des situations variées : 99,9% de diesel à une concentration de 5mg.kg-1 est ainsi bioatténué au bout de 74 jours dans un sol argileux, et un abattement de 90% de TCE par adsorption sur du sol a été constaté par Brigmon et coll. (1998). La température et le manque de nutriments peuvent fortement affecter l’efficacité de la bioatténuation : en 3 ans, 50% de diesel à 2,6µg.kg-1 est dissipé dans un sol alpin (Margesin et Schinner 2001), tandis que 20000L de fuel renversés accidentellement sur un sol subantarctique présentant une activité microbienne sont peu dégradés un an après. La bioatténuation des HAP de faible poids moléculaire est aussi possible avec des taux d’atténuation variant entre 0,000027 et 0,063jb1 (Rogers et coll. 2002). Cette méthode aléatoire, mais elle peut néanmoins être tentée dans un premier temps, avant de passer éventuellement à des méthodes plus sophistiquées, mais aussi plus coûteuses.
La biostimulation qui repose sur la stimulation de l’activité des communautés présentes sur le site pollué par ajout de: à Nutriments (azote, phosphore…) à Accepteurs d’électrons (O2 pour une dégradation aérobie, NO3 – ou SO4 2- pour une dégradation anaérobie) à De surfactants* d’origine chimique ou biologique pour augmenter la biodisponibilité des polluants les plus hydrophobes (hydrocarbures, PolyChloroBiphényles…).
La bioaugmentation vise à traiter les matrices polluées par l’ajout sélectif de cultures pures ou de consortia microbiens, ou de gènes de dégradation adaptés afin qu’ils soient transférés à la microflore indigène. Cette technique s’avère utile lorsque la matrice à traiter est pauvre en microorganismes pour la dégradation du polluant considéré ou lorsque les microorganismes ne sont pas adaptés. La bioaugmentation peut aussi se pratiquer avec du sol ou sédiment exposé au polluant, méthode appelée « sol activé ». On favorise alors au sein de la communauté bactérienne, les populations tolérantes aux polluants ciblés ; dans le meilleur des cas celles qui les dégradent. Cette sélection « naturelle » évite ainsi une étape lourde de sélection dirigée et permet par ailleurs de valoriser des bactéries non cultivables puisqu’on ne passe pas par une étape préalable de culture.
Les conditions physico-chimiques influencent fortement l’ampleur de la biodégradation : ainsi le temps de dégradation des polluants peut être multiplié par deux entre une modalité aérobie une autre anaérobie et les capacités dégradantes d’un sol sont fortement dépendantes du pH, avec un optimum de dégradation autour de pH 7, plutôt que dans un sol de pH 4-5. Un taux d’humidité trop faible peut multiplier la durée de dégradation par 1,5 à 5. L’efficacité de la bioremédiation dépendra de la capacité de dégradation des microorganismes utilisés et de la disponibilité du produit pour les microorganismes, c’est-à-dire au mieux la bioaccessibilité de ce dernier. Les interactions possibles entre les microorganismes et les polluants sont : le temps de 1/2 vie du contaminant étudié dans le sol passe de 14 à 19 pour un amendement du sol avec des résidus de chêne et de 14 à 43 jours pour un amendement du sol avec des résidus de pin ; les auteurs expliquent cette dégradation réduite par une plus faible biodisponibilité du polluant pour les microorganismes. Enfin dans une étude sur la dégradation de l’atrazine par des microorganismes dans un mélange sol – eau (Park et coll. 2003), la portion d’atrazine dissoute est dégradée dans la majorité des modalités étudiées, contrairement à la portion sorbée.
La remédiation des hydrocarbures
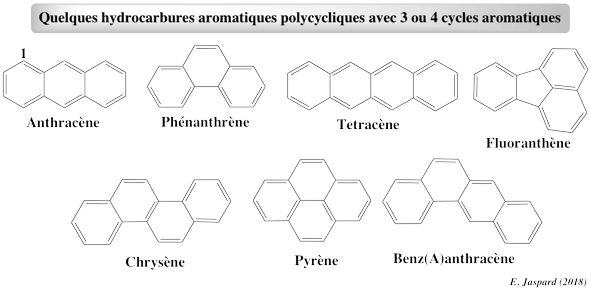
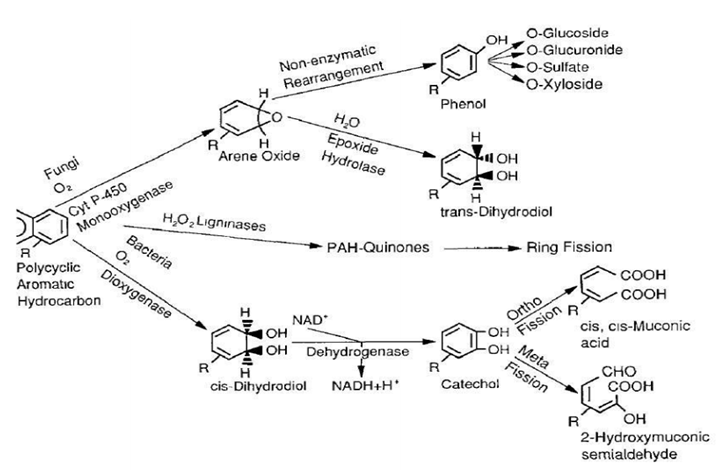
Les Hydrocarbures Aromatiques Polycycliques (HAPs) sont des polluants organiques persistants largement répandus dans l’environnement et en particulier dans les sols, car ils sont inclus dans la formulation des pesticides, présent dans le bitume des routes. Dans les carburants on trouve des hydrocarbures linéaires. Ils s’introduisent dans l’organisme humain par l’inhalation, ingestion ou assimiler par la peau car ils sont lipophiles. Ils sont biodégradables notamment par rhizofiltration. L’ensemble de ces modifications chimiques se caractérisent par des changements structuraux mineurs qui favorisent l’activité des microorganismes et donc leur dégradation.
Tout au long de leur coévolution, les plantes et les microorganismes ont développé des relations complexes résultant d’un échange constant d’informations moléculaires. Les agents pathogènes ont élaboré toute une gamme de stratégies offensives pour parasiter les plantes et en contrepartie, les plantes ont déployé un arsenal défensif similaire à bien des égards aux défenses immunitaires animales. Les percées récentes en biologie moléculaire et en transformation des végétaux ont démontré que sensibiliser une plante à répondre plus rapidement à l’infection pouvait lui conférer une protection accrue contre des microorganismes virulents. Un aspect important dans la mise en évidence du rôle joué par les molécules de défense au niveau de l’expression de la résistance est une connaissance exacte de leur localisation spatio-temporelle dans les tissus en état de stress. Afin de cerner le processus associé à l’induction de résistance chez les plantes, l’effet d’éliciteurs biologiques, microbiens et chimiques sur la réponse cellulaire des plantes envers une attaque pathogène a fait l’objet d’investigations et les mécanismes impliqués dans le phénomène ont été étudiés. Dans tous les cas, il a été montré qu’une corrélation existait entre la réponse globale de la plante et des changements dans la biochimie et la physiologie des cellules, lesquels étaient accompagnés de modifications structurales incluant la formation d’appositions pariétales riches en callose et l’infiltration de composés phénoliques aux sites de pénétration potentielle par l’agent pathogène. L’activation du sentier des phénylpropanoïdes est un phénomène crucial dans la restriction de la croissance de l’agent pathogène et dans la survie des cellules-hôtes en conditions de stress. Bien qu’il n’existe que peu d’exemples d’application pratique de la résistance induite en tant que méthode de lutte contre les maladies des plantes, les résultats obtenus à partir de quelques expériences menées en plein champ et en serre sont encourageants et indiquent que cette approche a le potentiel de devenir une stratégie de lutte efficace et durable contre toute une gamme d’agents pathogènes.
Dans le monde, des millions de sites pollués sont répertoriés en héritage de plusieurs décennies d’activités industrielles. Ce phénomène engendre des préoccupations sociétales en lien avec les potentiels impacts sanitaires. En Europe, les évolutions structurelles du secteur industriel conduisent à l’arrêt de nombreuses exploitations et donc à l’augmentation des friches industrielles. En effet, le nombre de sites présentant des activités potentiellement polluantes, en activité ou à l’arrêt, se situe à environ 3 millions. Près de 250 000 sites du secteur minier, industriel ou encore militaire peuvent nécessiter un traitement urgent. Si les tendances actuelles se poursuivent, sans modification de la législation, les chiffres rapportés ci-dessus devraient augmenter de 50 % en 2025. En France, près de 5957 sites et sols pollués, (SSP) ou potentiellement pollués ont été recensés en mars 2015 dans BASOL (http://basol.environnement.gouv.fr). A l’échelle nationale, 25% des SSP inventoriés dans BASOL sont pollués par les métaux et métalloïdes et 65% par les différentes familles d’hydrocarbures (aliphatiques, aromatiques, chlorés) (Rapport du Ministère de l’Ecologie, du Développement durable et de l’Energie, novembre 2013). De plus, certains hydrocarbures ont des propriétés mutagènes et/ou cancérigènes et présentent un risque avéré pour la santé humaine. Du fait de leur hydrophobicité élevée, ces molécules s’adsorbent fortement aux matières particulaires dont celles du sol rendant leur élimination et/ou leur transformation difficiles. Plus les hydrocarbures comportent d’atomes de carbone, plus leur adsorption sur les particules augmente, tandis que leurs solubilité, biodisponibilité, et surtout biodégradabilité diminuent. Si le seul argument de santé milite pour une décontamination des sites, il ne faut pas oublier qu’à cause du danger qu’ils présentent, tous ces sites pollués sont inutilisables en l’état. Autant de surface perdue, à moins d’une réhabilitation ad hoc. L’enjeu est d’autant plus important que nombre de sites pollués se trouvent souvent en zone urbaine où la pression foncière est extrêmement forte et où il convient de restreindre l’étalement urbain dommageable à l’environnement. C’est ainsi que sur le plan national, la loi Grenelle II vise à achever l’inventaire des sites pollués « historiques » afin d’établir les priorités d’action (présence de points d’eau, populations sensibles exposées…) et souligne dans son article l’importance d’utiliser les techniques de dépollution par les plantes. La phytoremédiation utilise la capacité naturelle des plantes et des microorganismes associés à contenir, biodégrader ou minéraliser les polluants.
Cependant, l’efficacité de cette phytotechnologie est limitée, en raison de la phytotoxicité et/ou de la faible biodisponibilité de certains polluants. Bien que cette méthode ait fait l’objet de nombreux travaux de recherches depuis les années 1990, les connaissances restent encore parcellaires et l’application « pratique » de cette technologie n’est qu’à ses balbutiements et est mal maîtrisée. L’optimisation de cette méthode passe par un choix adéquat de l’espèce végétale, et notamment par l’utilisation de plantes tolérantes aux polluants et favorisant la croissance des populations microbiennes rhizosphériques à capacité dégradantes. En effet, les racines stimulent l’activité microbienne et modifient les propriétés physico-chimiques de la rhizosphère. Parmi les microorganismes qui influencent les processus rhizosphériques figurent les champignons mycorhiziens à arbuscules (CMA) qui sont omniprésents dans la plupart des sols naturels et anthropisés (Smith et Read, 2008). On estime que plus de 80% des plantes terrestres vivent en symbiose avec ces champignons. Les CMA procurent de nombreux avantages à la plante hôte, dont une meilleure croissance due à une nutrition hydrique et minérale améliorée, ainsi qu’à une meilleure tolérance aux stress biotiques et abiotiques.
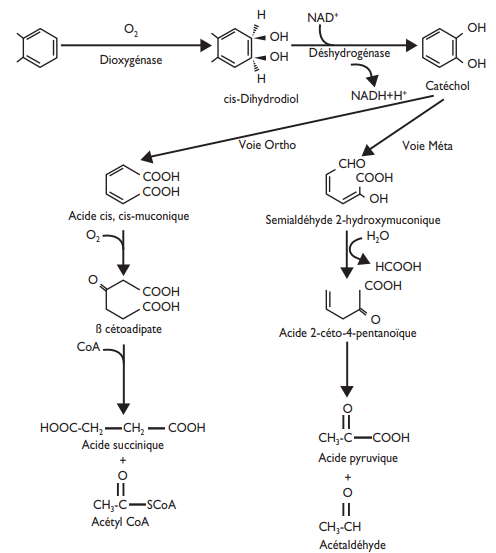
Des travaux antérieurs menés à l’UCEIV ont montré que les hydrocarbures aromatiques polycycliques (HAP) provoquent un stress oxydant qui est atténué lorsque les racines sont mycorhizées. Cette protection a été mise en évidence grâce à une plus faible production de malondialdéhyde (marqueur de peroxydation lipidique) et de 8-hydroxy2’-desoxyguanosine (marqueur d’altération de l’ADN), mais également par l’induction d’enzymes antioxydantes telle que la superoxyde dismutase. De plus, il a été montré que l’effet bénéfique apporté par la mycorhization est lié à certaines modifications lipidiques et à une réparation des dommages membranaires induits par les HAP. Cependant les mécanismes moléculaires impliqués dans la tolérance à la toxicité des HAP de la symbiose mycorhizienne arbusculaire et de chacun de ses partenaires sont encore mal connus. C’est pourquoi, le premier objectif de la présente thèse a consisté à étudier, chez un CMA et une plante hôte, l’expression de certains gènes potentiellement impliqués dans la tolérance aux HAP. Lors de cette étude, nous avons utilisé un système de culture monoxénique avec des racines de Medicago truncatula cv. Jemalong, transformées par Agrobacterium rhizogenes, et mycorhizées ou non par le CMA Rhizophagus irregularis et ce en absence ou en présence d’un HAP, le benzo[a]pyrène (B[a]P). En plus de l’effet protecteur apporté par les CMA aux plantes, il a été démontré que ces champignons pouvaient augmenter la dissipation des polluants organiques. En effet, l’expérience de Verdin et al, 2006 réalisée à l’UCEIV avec des cultures in vitro a révélé que la symbiose mycorhizienne améliorait la dissipation de l’anthracène grâce à une meilleure biodégradation et à une accumulation de cet HAP dans les globules lipidiques des cellules racinaires et fongiques.
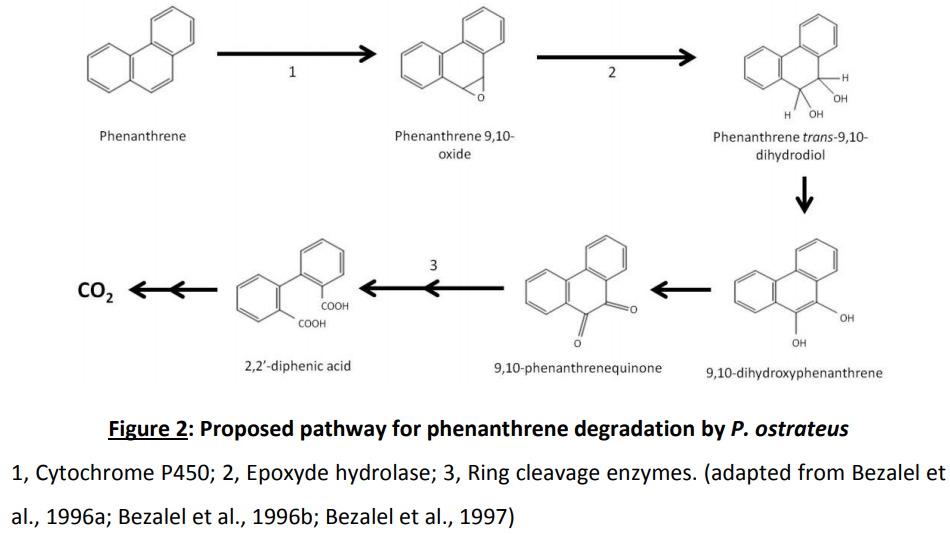
Remédiation de métaux
Universités en Biologie Végétale Par ESTEBAN REMON Tolérance et accumulation des métaux lourds par la végétation spontanée des friches métallurgiques : vers de nouvelles méthodes de bio-dépollution : Tolérance aux métaux lourds chez les végétaux.
Parmi les principaux polluants générés par les activités industrielles, les métaux lourds, tels que le Cu, le Pb, le Cr… posent des problèmes particulièrement préoccupants. En effet, ces éléments, par nature non biodégradables, présentent une forte écotoxicité et pourraient être impliqués dans de nombreuses pathologies. Ainsi, pour reprendre les termes d’un récent rapport de l’Office Parlementaire des Choix Scientifiques et Technologiques : « si les métaux lourds ont fait la civilisation, ils peuvent aussi la défaire ». Il est donc aujourd’hui indispensable non seulement de mieux connaître les effets de ces polluants sur les organismes vivants, mais aussi de mettre en œuvre des solutions durables, visant à limiter leurs risques. Dans ce contexte, les plantes représentent un objet d’étude intéressant. En effet, celles-ci, directement confrontées aux composés toxiques du milieu, pourraient non seulement être utilisées en tant que marqueurs de la toxicité du milieu, mais aussi en tant qu’outil de stabilisation des polluants. Cependant, à l’heure actuelle, les données concernant l’influence des métaux lourds sur les communautés végétales soumises à une exposition chronique de polluants, de même que le rôle des plantes sur le devenir des métaux, sont encore insuffisantes. Il est donc nécessaire de poursuivre les recherches dans ce domaine afin de mieux comprendre les modalités des interactions entre les plantes et les milieux pollués et de trouver de nouvelles espèces utilisables dans des programmes de phytoremédiation. Pour répondre à cet objectif, l’étude des populations végétales naturelles de trois crassiers métallurgiques de la région Rhône-Alpes a été réalisée. Malgré de fortes teneurs en métaux lourds, les relevés réalisés ont permis de répertorier un peu plus de 200 espèces de plantes supérieures appartenant à une cinquantaine de familles botaniques. Par ailleurs, l’utilisation d’une méthode chimique normalisée a montré que la fraction métallique “phytodisponible” était importante. Par opposition, l’analyse des concentrations foliaires n’a pas permis de mettre en évidence une accumulation métallique supérieure à celle retrouvée dans une plante référence. Par conséquent, le risque de transfert des polluants métalliques apparaît limité. L’analyse des relevés phytosociologique a cependant révélé que le substrat influence l’organisation de groupements végétaux inédits, qui pourraient être utiles pour désigner la végétation la plus adaptée pour un programme de phytoremédiation. Au sein de ces groupements, une espèce abondante, Plantago arenaria Waldst. & Kit on montré de bonnes capacités de tolérance vis-à-vis de différents métaux lourds, en particulier pour le cadmium. Il s’est révélé que la tolérance de cette espèce est un caractère constitutif pour le Cd et le Ni et un caractère adaptatif pour le Cu. Cette bonne tolérance constitutive pourrait être une caractéristique des plantes pionnières et résistantes à la sécheresse. Chez cette espèce, les mécanismes de résistance au cadmium semblent impliquer une activation du système antioxydant racinaire et une limitation de la translocation. La suite possible de ce travail pourrait consister à orienter les recherches vers les mécanismes complémentaires de la résistance aux métaux lourds chez P. arenaria et notamment en ce qui concerne les phénomènes de chélation intracellulaire.
Certains éléments métalliques sont essentiels aux organismes vivants à de faibles concentrations. Mais, ils agissent à de fortes concentrations comme un facteur de stress qui entraîne une modification de la réaction physiologique. Le terme « sensibilité » décrit les effets du stress, qui peuvent aller jusqu’à la mort de la plante. Par opposition, le terme « résistance » fait référence à la réaction de la plante qui lui permet de survivre face au stress métallique et d’assurer sa descendance. Deux stratégies principales sont impliquées dans ce phénomène de résistance :
• la stratégie d’évitement par laquelle les plantes se protègent du stress métallique en limitant leur absorption ; • la stratégie de tolérance qui fait référence aux réactions permettant de limiter les effets néfastes des métaux dans l’organisme. Ces différents aspects sont abordés de façon à comprendre la physiologie de la plante vis-à-vis des métaux lourds. Pour terminer, nous développerons les stratégies d’utilisation des plantes dans une optique de phytoremédiation des sols contaminés. Parmi l’ensemble des métaux lourds, 36 d’entre eux sont indispensables aux processus physiologiques majeurs, en particulier la respiration, la photosynthèse ou l’assimilation des macronutriments. Nombre de ces métaux, Cu, Zn, Ni, Fe, Co, Se et Ba sont aussi impliqués au niveau de processus moléculaires tels que le contrôle de l’expression des gènes ; la biosynthèse des protéines, des acides nucléiques, des substances de croissance, de la chlorophylle et des métabolites secondaires ; le métabolisme lipidique ou la tolérance au stress. En outre, certains éléments trace peuvent se présenter sous différents états considérés comme des poisons cellulaires pour lesquels les doses admissibles sont très faibles. On retrouve parmi les plus toxiques, Hg, Cr, Ni, Pb et Cd. La voie principale d’absorption des métaux se fait par simple diffusion au travers de l’apoplaste du cortex racinaire et de l’endoderme. Le transport des éléments métalliques à travers la paroi cellulaire se fait passivement (non métabolique et donc dans le sens du gradient de concentration) par les pores du réseau de la cellulose, de l’hémicellulose et des glycoprotéines. Cependant, une partie des ions peut être adsorbés par les charges négatives de surface de l’acide polygalacturonique des pectines, qui agissent comme des échangeurs d’ions. Puis au niveau de l’endoderme, le transport peut devenir actif au niveau de la membrane plasmique des cellules de la bande de Caspary (voie symplastique), autorisant cette fois un transfert contre le gradient de concentration. Cependant, les mécanismes exacts de l’absorption sont encore mal connus, en particulier pour certains éléments comme le Cu, et diffèrent selon l’espèce métallique.
On considère de nos jours que le plomb et le nickel sont absorbés passivement via certaines protéines de type porine, alors que le zinc et le cuivre sont absorbés activement par une protéine de transport sélective, nécessitant de l’énergie. Par ailleurs, bien que le transport actif soit en principe spécifique, certains cations toxiques (Cs, Cd, Pb ou Cr) sont des compétiteurs potentiels vis-à-vis des cations essentiels. Par exemple, le cadmium semble être un compétiteur connu du calcium en empruntant les canaux calciques membranaires. 70% du Cd entrerait dans la racine par ce biais là. Une partie des métaux apoplastiques peut donc rejoindre la voie symplastique puis le xylème par les plasmodesmes. Après leur absorption, le transport des éléments dans le xylème de la plante vers les parties aériennes, appelé « translocation », peut nécessiter ou non la prise en charge des éléments par des agents complexants, tels que les acides organiques, les acides aminés et divers peptides : le fer est pris en charge par le citrate ; le zinc peut être transporté par un complexe anionique ; la majorité du cuivre et une partie du nickel sont chélatées par un acide polyaminopolycarboxylique encore non identifié chez la tomate ; le cadmium est transporté sous forme libre. Chez certaines espèces la translocation d’éléments toxiques est plus importante que chez d’autres, pouvant conduire à une accumulation des métaux dans les feuilles et les autres parties aériennes, sans que l’on sache avec rigueur si elle est due à un transport plus actif ou une absence d’immobilisation dans les racines.
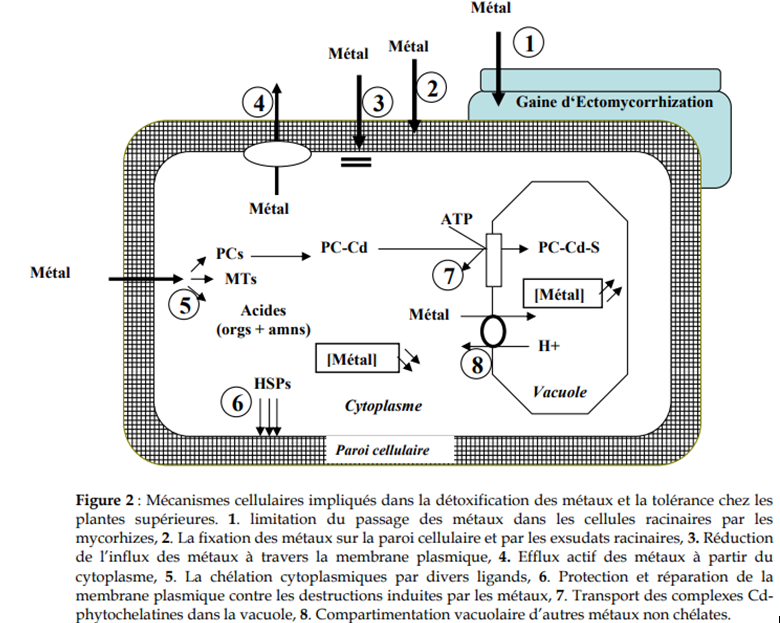
Le transport des éléments toxiques par le phloème est moins évident du fait que les cellules qui le constituent sont vivantes et forment un piège supplémentaire. Toutefois, chez certaines plantes, la nicotianamine, dérivée de la méthionine, pourrait être responsable du transport des métaux, Fe, Cu, Zn et Mn, dans la sève du phloème. Certaines plantes accumulent des quantités inhabituelles d’éléments métalliques ; 100 mg/kg de matière sèche pour le Cd, 1000 mg/kg pour le Ni, le Cu, le Co ainsi que 10 000 mg/kg pour le Zn et le Mn. Ces espèces sont alors qualifiées de plante « hyperaccumulatrice ». Ainsi, plus de 400 espèces hyperaccumulatrices sont recensées, dont plus de 300 pour le nickel et seulement une pour le cadmium. A part une possible résistance à la sécheresse et aux herbivores, il est encore impossible d’attribuer ce phénomène à un avantage sélectif quelconque. Dans la cellule, les métaux ayant pénétré dans le cytoplasme sont pris en charge par diverses molécules afin de les stocker ou d’éviter tout dommage cellulaire. Le premier effet des métaux lourds observable chez les végétaux est une inhibition de la croissance. Celle-ci s’accompagne très souvent de nombreux autres indices de dysfonctionnement : chlorose foliaire, importantes lésions nécrotiques, jaunissement progressif, repliement ou dessèchement du feuillage… A l’heure actuelle, les bases moléculaires de ces perturbations sont encore mal connues, mais on admet généralement qu’elles résultent d’un stress oxydatif, dû à la production d’espèces réactives de l’oxygène ou « Réactive Oxygen Species » (ROS). Les ROS altèrent toute une série de substrats biologiques importants, avec comme conséquence la modification des domaines fonctionnels des biomolécules : inhibition de l’activité enzymatique, perturbation du métabolisme végétal (notamment la photosynthèse et la respiration), oxydation de protéines, altération des membranes cellulaires via l’induction de phénomènes de péroxydation lipidique, apparition de cassures au sein de l’ADN. Il est représenté par un peptide de 339 acides aminés avec 8 domaines transmembranaires. Chez A. thaliana, est exprimé dans les racines en réponse à une carence en fer. Les caractéristiques de ce transporteur et les données physiologiques indiquent que ce système n’est pas spécifique ; il pourrait également transporter d’autres ions divalents comme le zinc et le cadmium. Cette compétition entre différents ions entraînerait une déficience en fer responsable des signes visibles de chlorose. D’autres systèmes comparables ont été mis en évidence par expression fonctionnelle chez A. thaliana. Ainsi, COPT1 est un transporteur connu du cuivre, retrouvé dans les fleurs, les tiges et les feuilles, mais pas dans les racines. Ceci suggère que son implication dans l’absorption racinaire est peu probable. Par opposition, ZIP1 et ZIP3, exprimés lors d’une carence en zinc, sont exclusivement racinaires, et seraient par conséquent impliqués dans l’absorption racinaire. Enfin, ZIP4, localisé à la fois dans les parties racinaires et aériennes, jouerait un rôle dans la translocation du zinc. La modulation de l’expression de ces gènes pourrait donc contribuer largement à la tolérance observée chez certaines espèces. Ainsi, le site principal de la toxicité au cuivre chez Silene vulgaris est la membrane plasmique racinaire qui est altérée par peroxydation lipidique. Dans une étude menée sur un couple écotype de contrôle-écotype tolérant, la perméabilité membranaire vis-à-vis du cuivre est mise en évidence par un efflux de potassium plus important chez le contrôle que chez l’écotype tolérant. Pourtant les deux écotypes répondent de la même façon à un stress oxydant donné. Par conséquent, la tolérance serait due à un mécanisme limitant l’entrée de cuivre au niveau de la membrane plasmique des cellules. En résumé, la tolérance pourrait être due à la protection de l’intégrité membranaire ou à la protection de la fonction des protéines associées au plasmalemme, tels que les transporteurs, les canaux ioniques et les pompes à protons.
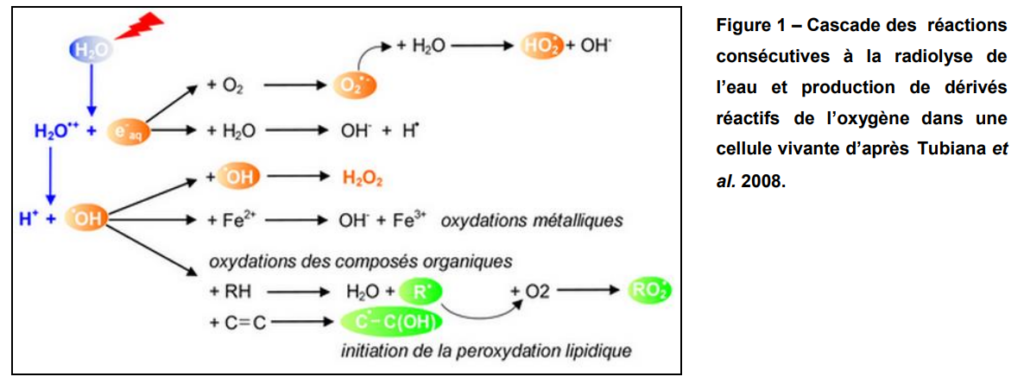
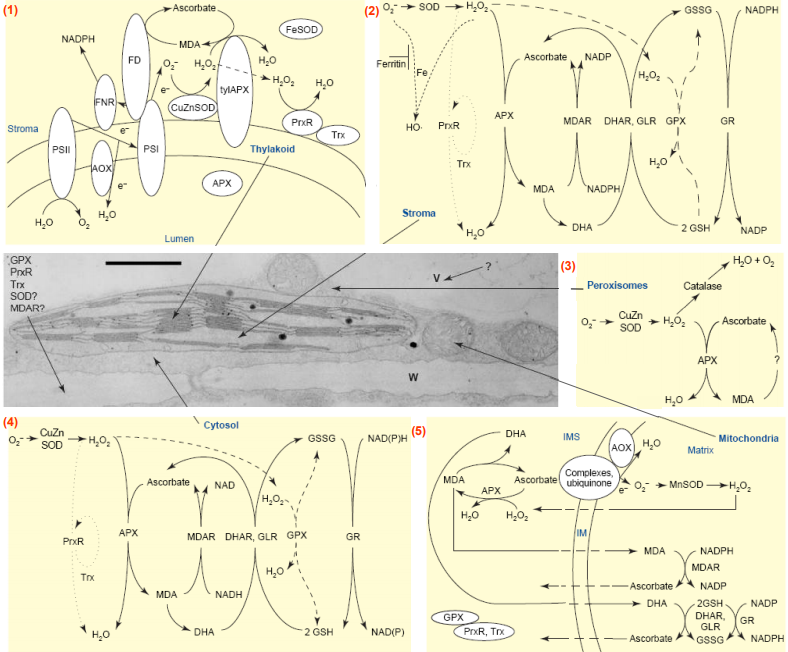
Le système anti-oxydant jouerait un rôle central dans la détoxication des métaux lourds ayant pénétrés dans la cellule. Il est donc important de bien comprendre d’une part les événements conduisant à un stress oxydant et d’autre part les mécanismes biochimiques impliqués dans la réponse à ce stress. Les métaux lourds induisent l’accumulation de ROS Le rôle des métaux lourds dans la formation des ROS est lié à leur capacité à exister sous différents états d’oxydation. En effet, les cations d’éléments comme Fe, Cu, Cr ou Mn sont capables céder un ou plusieurs électrons susceptibles de réduire l’oxygène et ses dérivés. La plus connue de ces réactions est la réaction de Fenton qui se produit en présence de fer ferreux et qui conduit à la réduction du peroxyde d’hydrogène (H2O2) en radical hydroxyl (•OH) et en anion hydroxyl (OH– ) : H2O2 + Fe2+ •OH+ OH– + Fe3+ (1) Les radicaux libres sont des espèces chimiques qui possèdent un électron célibataire qui, parce qu’il n’est pas apparié à un autre électron de spin opposé, confère à la molécule une très forte réactivité. Le radical hydroxyle •OH, produit au cours de cette réaction, est un puissant agent oxydant. D’autres réactions de ce type faisant intervenir des métaux réduits ont également été décrites, telle que la réaction d’Haber-Weiss au cours de laquelle le peroxyde d’hydrogène réagit avec un radical superoxyde, comme l’anion superoxyde •O2 – , aboutissant, là encore, à la production du radical hydroxyle. H2O2 + •O2- + Fe2+ •OH + OH- + O2 + Fe3+ Par ailleurs, même des métaux qui n’existent que sous un seul état d’oxydation, tels que le cadmium et le nickel par exemple, peuvent induire une accumulation de ROS pour trois raisons : une perturbation de certaines voies métaboliques, une inactivation et un « down régulation » des enzymes du système anti-oxydant ou un épuisement du stock de molécules de faible masse moléculaire comme l’ascorbate, le glutathion, la vitamine E ou les caroténoïdes, qui présentent des capacités anti-oxydantes. Le système anti-oxydant contrôle la production de ROS Trois activités enzymatiques clefs occupent une place centrale dans les mécanismes de détoxication des ROS : il s’agit des superoxyde-dismutases (SOD), des catalases (CAT) et des peroxydases (POX). Ces enzymes ont une action complémentaire sur la cascade radicalaire au niveau de l’anion superoxyde •O2- et du peroxyde d’hydrogène, conduisant finalement à la formation d’eau et d’oxygène moléculaire. Les superoxyde-dismutases, SODs, sont responsables de la dismutation de l’anion superoxyde en peroxyde d’hydrogène (H2O2), selon la réaction : 2 •O2- + 2H+ H2O2 + O2 Ces enzymes existent sous différentes isoformes, dont la structure d’ensemble est très bien conservée au cours de l’évolution : le repliement tridimensionnel forme un puits hydrophobe au centre de la protéine, dans lequel se glisse l’anion superoxyde. Le mécanisme réactionnel est catalysé par un métal divalent situé au cœur de l’enzyme. Selon la nature de ce métal on distingue les superoxyde-dismutases à manganèse (Mn-SOD) localisées dans les mitochondries, les superoxyde-dismutases à cuivre-zinc (Cu/Zn-SOD), cytosoliques et enfin, les superoxydedismutases à fer ferreux (Fe-SOD), localisées dans le chloroplaste. L’équation (4) décrit la chaîne catalytique typique avec le cuivre : 2Cu2+-SOD + •O2- 2Cu+ -SOD + •O2- + 2H+ 2Cu2+-SOD + H2O2. Les catalases, CATs, sont contenues dans les peroxysomes et dans le cytosol. Elles agissent en synergie avec les SODs puisque leur rôle est de catalyser la réduction du peroxyde d’hydrogène en eau et en oxygène moléculaire selon la réaction suivante : 2 H2O2 2H2O +O2 Les peroxydases, POX, permettent, comme les catalases, la réduction de H2O2 en eau et en oxygène moléculaire. Cependant, à la différence des catalases, les POX nécessitent la présence d’un substrat particulier pour réaliser leurs activités. Deux types principaux de « molécules antioxydantes » sont utilisés comme substrat par les peroxydases : l’acide ascorbique et le glutathion (GSH). Ces deux molécules participent au cycle « ascorbate/glutathion », dont la première étape consiste en une réduction du peroxyde d’hydrogène en H2O, couplée à une oxydation de l’ascorbate en monodéhydroascorbate (MDHA) ; cette étape est catalysée par l’ascorbate peroxydase (APX). Pour permettre la poursuite de cette réaction, l’ascorbate oxydé doit être à nouveau réduit. Pour cela, deux voies (directe et indirecte) de régénération de l’ascorbate coexistent : La réduction directe du MDHA par la monodéhydroascorbate réductase (MDHAR) via l’oxydation d’une molécule de NAD(P)H. Cependant, le MDHA est une molécule relativement instable qui a tendance à se dismuter spontanément en déhydroascorbate (DHA) et ascorbate. La seconde voie de régénération de l’ascorbate consiste donc en une réduction du DHA par la déhydroascorbate réductase (DHAR), couplée à une oxydation du GSH. Enfin, le glutathion oxydé, produit au cours de cette dernière réaction, est régénéré en GSH grâce la glutathion réductase (GR).
Remédiation des pesticides
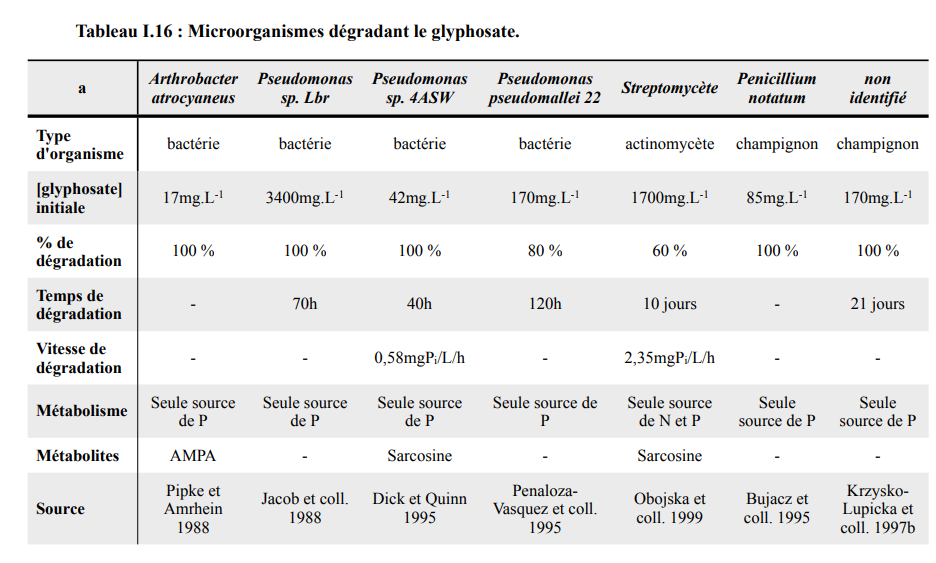
Selon les différents travaux de : Claire BLONDEL, le 15 décembre 2014, Potentialité de phytoremédiation de matrices polluées par des organochlorés Fonctionnalité de la rhizosphère. Angélique San Miguel, le 1er décembre 2011, Phytoremédiation des organochlorés. Etude mécanistique et fonctionnelle des capacités épuratrices du système plante-rhizosphère au Laboratoire d’Ecologie alpine (LECA) dans l’École Doctoral Ingénierie pour la Santé, la Cognition et l’Environnement
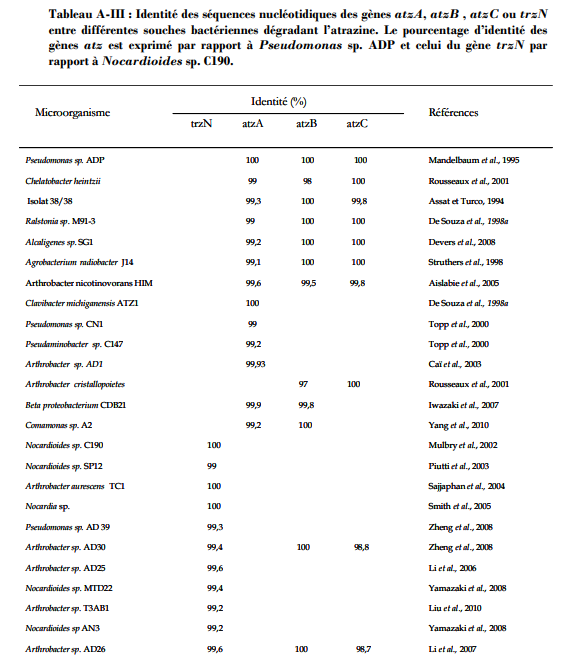
Frédérique CHANGEY, L’UNIVERSITE DE BOURGOGNE INRA-DIJON, Le 16 décembre 2011, ETUDE DE L’EVOLUTION DU POTENTIEL GENETIQUE DE POPULATIONS BACTERIENNES DEGRADANT L’ATRAZINE.
Revue d’Ecologie (Terre et Vie), Vol. 71, 2016 : 203-221 203 IMPLICATIONS DES COMMUNAUTÉS VÉGÉTALES PÉRI-AGRICOLES DANS LA DYNAMIQUE ENVIRONNEMENTALE DES POLLUTIONS PAR LES PESTICIDES
Les techniques de réhabilitation doivent être adaptées à la nature chimique des polluants et peuvent correspondre à la limitation de la mobilité des polluants (flux électrique, vitrification in situ…) ou à l’élimination partielle ou totale de la pollution en utilisant des procédés chimiques, thermiques, physiques ou biologiques. Souvent ces méthodes sont écologiquement destructrices (excavation et export des matrices, introduction d’autres produits chimiques) rendant ces matrices non fonctionnelles. En France, 75% des sites pollués (friches industrielles, zones urbaines) sont traités par ces techniques (ADEME). Cependant, lorsque les surfaces polluées sont de grande ampleur (plusieurs milliers d’hectares comme le cas des Antilles), ces solutions ne peuvent s’appliquer (limitation par le tonnage des excavations, coût trop important, destruction écologique trop importante). Les techniques de remédiation in situ, représentant environ 26% des cas de dépollution en France, sont alors une solution plus adéquate (ADEME, 2008). Les techniques de dépollution biologique en constante évolution et développement, sont envisageables avec un faible coût de réalisation et de gestion et peuvent s’appliquer sur de grandes surfaces ou volumes.
Les microorganismes sont ubiquitaires dans la biosphère, leur diversité génétique et physiologique compose un potentiel métabolique de première ampleur contribuant entre autres aux cycles biogéochimiques au niveau local et global. Cet arsenal métabolique peut être mis à contribution en utilisant les microorganismes afin d’absorber et de biotransformer les contaminants. Il s’agit de la bioremédiation. Cette technique s’applique dans un environnement hétérogène dans lequel la plupart du temps, les contaminants sont présents en association avec des particules du sol, dissous dans la solution du sol, en milieu oxygéné et anoxique. De plus, le potentiel de dégradation des contaminants organiques varie selon les microorganismes et la dose de toxique. Il faut aussi tenir compte des différentes communautés microbiennes avec leurs synergies et leurs antagonismes (Megharaj et al, 2011). Il existe deux sortes de procédés de bioremédiation : « in situ » correspondant au traitement d’un site pollué au sein même de celui-ci et « ex situ » impliquant une extraction du sol pour le traiter ailleurs. Cependant, la bioremédiation in situ est préférable afin de permettre la restauration écologique d’un environnement. Ces traitements « in situ » visent à activer les processus de biodégradation, et à améliorer l’accessibilité des microorganismes à l’oxygène :
· La biostimulation : Le principe est d’augmenter la dégradation de produits chimiques par l’addition d’eau, de nutriments, d’accepteurs ou de donneur d’électrons. On peut ainsi accélérer l’action des bactéries en modifiant les sources de carbone, d’azote, de phosphore, la température, l’oxygène disponible, le pH du sol.
· La bioaugmentation : Il s’agit d’ajouter des microorganismes dégradant ou transformant les polluants. Les bactéries sont présélectionnées pour être capables de vivre dans un environnement pollué. Cependant, il faut néanmoins être prudent avec l’introduction de nouvelles espèces dans un environnement car cela pourrait avoir un impact sur la faune et la flore autochtones. La modification génétique des microorganismes est aussi une piste possible. En effet, il est possible d’optimiser les enzymes et les voies de dégradation des bactéries.
De manière générale, dans une large gamme de stress chimiques provoqués par des xénobiotiques de cibles variées, les organismes photosynthétiques subissent souvent un important stress oxydatif lié à une surproduction de ROS. Les ROS possèdent une forte réactivité générant des cascades de réactions d’oxydation de molécules biologiques. Les ROS sont naturellement et continuellement produites chez les plantes par différentes voies métaboliques, comme la respiration ou la photosynthèse, et sont retrouvées au niveau des mitochondries, des chloroplastes, des peroxysomes, du réticulum endoplasmique et du cytoplasme. Les ROS jouent un rôle important dans l’homéostasie cellulaire, et la balance entre la production et la détoxification des ROS peut être considérée comme essentielle pour de nombreux processus cellulaires. Les ROS sont de plus à l’origine d’un système de signalisation cellulaire, notamment en contexte de stress, pouvant induire des réponses adaptatives, y compris vis-à-vis des xénobiotiques, mais leur action signalétique peut aussi induire des processus de mort cellulaire programmée. En conditions de stress xénobiotique, la surproduction de ROS génère un stress oxydatif quand leur détoxification est moins performante ou inhibée. Les ROS perturbent alors le fonctionnement cellulaire du fait de leur action sur les protéines, sur les acides nucléiques et sur les lipides. Dans le cas de l’atrazine, l’inhibition du transfert d’électrons au niveau des photosystèmes empêche le retour de la chlorophylle excitée par l’énergie lumineuse vers son état fondamental. La chlorophylle transfère son énergie d’excitation au dioxygène, produisant ainsi de l’oxygène singulet très réactif, qui, avec d’autres ROS associés, déclenche la peroxydation des lipides et la destruction des pigments photosynthétiques, ainsi que l’induction de programmes de mort cellulaire. Cependant, les perturbations induites par les xénobiotiques sont généralement analysées chez des plantes soumises à un xénobiotique unique à forte concentration, et lorsqu’il s’agit de pesticides, à des concentrations de dose de traitement agricole. De plus, dans ce dernier cas, les modalités d’exposition expérimentale reflètent généralement les modalités de traitement agricole plutôt que les expositions diffuses au niveau des systèmes racinaires correspondant à des contaminations environnementales des sols.
Biodégradation par les bactéries
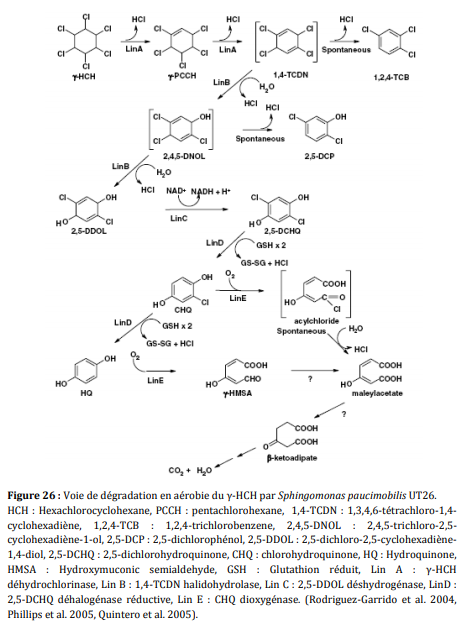
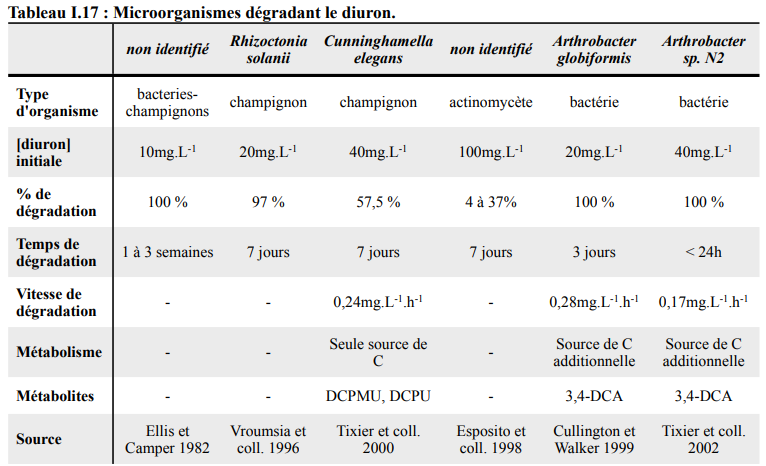
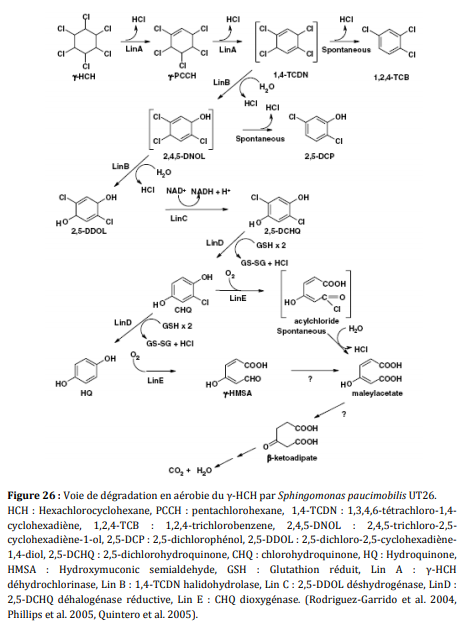
Le gHCH est dégradé en anaérobiose par les microorganismes suivants : Clostridium rectum, Clostridium sphenoids, Clostridium butyricum, Clostridium pasteurianum, Citrobacter freundii, Desulfovibrio gigas, Desulfovibrio africanus, Desulfococcus multivorans et Dehalobacter sp. (Lal et al, 2010). Le gHCH est plus rapidement dégradé que les autres isomères. La dégradation aérobie du gHCH est réalisée principalement par les bactéries de la famille des Sphingomonadaceae. Il existe différentes voies de dégradation en fonction des bactéries qui n’aboutissent pas forcément à la même molécule. De nombreuses bactéries de la famille des Sphingomonadaceae peuvent être sélectionnées, isolées et cultivées. De plus, le gHCH peut être dégradé aussi par certains champignons comme Rhizopusoryzae biomass. La CLD est stable dans les sols et ne semble pas se dégrader naturellement. Certains microorganismes ont la capacité de supprimer un ou deux chlore de la molécule mais pour le moment aucune étude n’a prouvé de façon péremptoire la minéralisation de la CLD par les microorganismes (Fernández-Bayo et al, 2013)
L’identification d’une souche bactérienne, Pseudomonas paucimobilis, rapportée dans la littérature comme active dans la biodégradation de certains pesticides, permet de suspecter fortement l’intervention de la biodégradation bactérienne au niveau des sédiments. P paucimobilis est largement connu quant à l’action de souches naturelles ou clonées dans la biodégradation par déhalogénation et déhydrochlorination du lindane, et de PCB, puisque ces produits actuellement retirés du marché ont largement été utilisés ces vingt dernières années. Les connaissances concernant l’atrazine sont plus récentes et confirment, elles aussi, l’action de certaines souches bactériennes, telles que Rhodococcus B30 et P fluorescens LMG10141 et P YAYA6. Ces souches de Pseudomonas cultivées en présence d’atrazine seule savent utiliser celle-ci comme source unique d’azote, et produisent du chlorure et du nitrate, via des déchlorinations et déalkylations. Le réacteur biphasique réalisé pour cette étude restitue avec une certaine fidélité la structure physique du milieu. Les conditions de température et d’oxygénation qui doivent être maintenues fixes, sont aisément contrôlables.
La Rhizodégradation
Au niveau du volume racinaire, l’action conjointe des plantes et des microorganismes peut jouer un rôle essentiel dans l’efficacité de remédiation des contaminants. La rhizodégradation correspondant à la dégradation des contaminants organiques est réalisée par les enzymes exsudées par les racines (oxydases, hydrolases) et en majorité par la microflore qui possède des capacités métaboliques importantes comme la rupture de cycle aromatique (laccases), la coupure de groupements cyanides (nitrilases), la coupure de groupements phosphates comme dans le cas des insecticides organophosphorés (phosphatases), l’élimination de chlore (déhalogénase) et des oxydations (monoxygénases P450). Des études récentes ont démontré l’augmentation significative de la disparition et/ou de la minéralisation des polluants organiques persistants au niveau de l’interface racines-sol. Les flavonoïdes et autres exsudats libérés par les racines peuvent stimuler l’activité biodégradante des bactéries vis-à-vis des PCBs ou des HAPs. Les OCPs semblent agir sur la structure communautaire des bactéries rhizosphériques puisque certains genres semblent particulièrement sensibles (Hevizibacter, Acidovorax) et d’autres apparaissent tolérants (Bacillus, Aeromonas, Pseudomonas, Sphingomonas) (San Miguel et al, 2014). Certaines souches bactériennes (Sphingomonas sp, Pseudomonas sp, Devosia sp, Sphingobium sp. isolées à partir de la rhizosphère de Withania somniferea, Solanum torvum, Erianthus munja et Lantana camera sont capables de biodégrader le gHCH ou d’autres OCPs. Quelques travaux ont aussi démontré l’effet positif des champignons rhizosphériques sur la dégradation des OCPs. Par ailleurs, les contaminants dégradés peuvent être plus facilement absorbés par les plantes ou alors, les activités microbiennes peuvent libérer à proximité des tissus racinaires des protons et/ou anions et/ou des chélateurs qui peuvent moduler localement les propriétés chimiques du sol. Ces éléments peuvent faciliter la phytoextraction (Abhilash & Singh, 2009). Par ailleurs, Alvarez et al. 2012 ont démontré que les exsudats de maïs améliorent l’absorption du gHCH par certaines souches bactériennes (Streptomyces).
Les relations plante-microorganismes-environnement
La rhizosphère est une zone densément peuplée dans laquelle les racines des plantes interagissent avec les systèmes racinaires des plantes voisines pour l’espace, l’eau, et les minéraux (Bais et al, 2004). Les racines absorbent de l’eau et des sels minéraux qui sont nécessaires à la nutrition de la plante. Le volume d’eau absorbé dépend de plusieurs paramètres (météorologie, physicochimie du sol, taux de transpiration, surface foliaire de la plante, espèce végétale,…) et ce prélèvement permet d’assurer une partie du drainage de l’eau dans le sol. L’absorption des ions par les poils absorbants racinaires s’effectue généralement contre une dépense d’énergie à l’aide de pompes à protons. Cette sortie d’éléments du sol vers la plante, ainsi que l’expulsion de protons par la pompe, peuvent modifier certains paramètres physico-chimiques du sol, comme le pH. Par ailleurs, la rhizosphère est une interface où il s’établit une relation fonctionnelle : l’effet des racines sur leur environnement et l’interaction avec les microorganismes (bactéries et champignons). Les interactions entre les plantes et les microorganismes sont influencées par des facteurs édaphiques qui sont les facteurs écologiques liés aux caractéristiques physiques et chimiques du sol. L’effet physique de la croissance des racines permet par exemple de faciliter les mouvements de fluides (O2 et H2O) et d’assister la migration des microorganismes dans le sol. De plus, les racines jouent un rôle majeur dans la fonctionnalité de la rhizosphère via les rhizodépôts qui sont de deux sortes : les exsudats et les débris. Les débris racinaires sont composés de cellules détachées, du contenu de cellules lysées ou de morceaux de racines mortes. Les exsudats sont constitués en majorité de sucres, d’acides aminés et d’acides carboxyliques diffusant passivement des racines vers le sol. Les exsudats racinaires peuvent donc modifier la structure et l’activité des communautés microbiennes. En effet, les exsudats racinaires peuvent attirer par chimiotactisme certaines bactéries symbiotiques ou au contraire éloigner les microorganismes pathogènes pour la plante. La microflore, fortement stimulée par l’activité racinaire, va jouer différents rôles au sein du milieu rhizosphérique. Celle-ci est capable de concentrer les ions dans l’environnement proche des racines et de faciliter la disponibilité de certains éléments comme l’azote ou encore le phosphore au bénéfice de toute la communauté rhizosphérique. Les microorganismes du sol peuvent également sécréter des substances dans leur milieu proche, comme des enzymes, capables de dégrader des exsudats racinaires très complexes, mais aussi des hormones ou encore des facteurs de croissance. Cela procure à la plante un bénéfice, de manière directe (stimulation de la croissance racinaire) ou bien indirecte (défense contre les pathogènes). Par exemple, les bactéries PGPR (Plant Growth Promoting Rhizobacteria) synthétisent des phytohormones de croissance auxin-like améliorant directement la croissance végétale mais pouvant également synthétiser des substances antifongiques limitant le développement d’agents pathogènes protégeant les tissus végétaux. Cependant, certaines interactions peuvent être négatives lorsque les microorganismes ou plantes voisines libèrent des substances (phytotoxines) pouvant par exemple affecter la croissance des plantes. La rhizosphère représente donc une interface complexe, biologiquement très active, et essentielle entre le sol et la plante. Ce micro-environnement dispose de sa propre fonctionnalité et peut être potentiellement perturbé par l’introduction de facteurs exogènes Dans le cas de polluants organochlorés, la présence de ces contaminants dans le milieu rhizosphérique induit un réarrangement des communautés microbiennes.
Le projet consiste à ensemencer des bactéries capables de digérer des pollutions diverses. Pour cela il faudrait récupérer des germes dans des milieux naturels sur les racines de plantes et les cultiver dans des zones artificielles.
Le phénomène d’adaptation bactérienne aux modifications environnementales est la matérialisation de l’immense plasticité génétique dont elles disposent. C’est d’ailleurs précisément ce paramètre qui a autorisé leur omniprésence d’un point de vue géographique (puisque capables de coloniser les milieux extrêmes) et biogéochimique (car indispensables à la réalisation des cycles naturels). Leur adaptation à la biodégradation des molécules d’origine anthropique constitue une autre prouesse évolutive à l’échelle temporelle, étant donné la fréquence à laquelle les activités humaines ont généré de nouveaux intrants. En effet, la présence de xénobiotiques va modifier la structuration populationnelle des microorganismes, bactéries et champignons. Néanmoins, en corrélation avec leur stratégie nutritionnelle ou énergétique, ils pourront en retour influer sur la concentration, le transfert et la transformation des molécules chimiques du sol. Les bactéries, en raison d’une capacité de multiplication élevée et d’une forte plasticité génétique, ont pu développer des résistances ou des stratégies nutritionnelles leur permettant de pallier ou d’utiliser la présence d’herbicides dans le sol.
Une multitude de variétés de bactéries phyto-épuratrices existent sur les racines de plantes aquatiques de diverses zones, cet un réservoir inexploité pouvant aider des milieux pollués à améliorer leurs fonctionnements. Réussir à cultiver ces bactéries dans des fermenteurs pour accroitre la biomasse serais l’enjeu majeur de cette études, Car le faible taux de cultivabilité des bactéries environnementales est de moins de 1%. Pourquoi ? Dans les laboratoires les milieux de cultures ne respectent pas les paramètres propices aux développements de germes environnementaux : qui sont ceux décrit dans les chapitres concernant la bioélectronique de Vincent et les degrés de cohérence de l’eau.
Chaque milieu possède une capacité d’adaptation pour répondre à chaque une pollution, soit de nouvelles plantes vont ce développé, soit des variétés latente de bactéries s’activent. Mais si les pollutions sont irrégulières le milieu n’a pas le temps de s’adapter.
